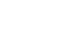次世代バイオ医薬品製造技術研究組合は、国立研究開発法人日本医療研究開発機構(AMED)が2021年度より実施する「次世代治療・診断実現のための創薬基盤技術開発事業( 国際競争力のある次世代抗体医薬品製造技術開発)」における研究開発課題1「次世代抗体医薬品の製造基盤技術開発」、2「次世代抗体医薬品の実用化に向けた物性・品質評価及び管理手法に関する技術的研究」、3「国産高機能抗体産生細胞株の社会実装に向けた技術開発」、4「バイオ医薬品製造プロセスの先端的シミュレーション技術の開発」に取り組みます。
上記課題に対応するため、国内の関連技術を保有する産学官が結集し、次世代抗体医薬品の要素技術の開発及び製造技術プラットフォームの構築を目指します。
研究コンソーシアム体制
2021〜2025年度「国際競争力のある次世代抗体医薬品製造技術」
 (2024年4月1日現在)
(2024年4月1日現在)
- ※
- 組合員ロゴの一部は、組合員ホームページの関連技術サイトとリンクしています。
- ※
- GMP:Good Manufacturing Practiceの略。
アメリカ食品医薬品局が定めた医薬品等の製造品質管理基準に準じるとともに、
日本の薬事法に基づいて定められた医薬品等の品質管理基準のこと。
神戸GMP集中研

神戸GMP集中研がある神戸大学統合拠点アネックス棟
大阪集中研

大阪集中研がある大阪大学吹田キャンパス
横浜集中研

横浜集中研があるかながわサイエンスパーク
福島GMP集中研

福島GMP集中研がある日本全薬工業株式会社
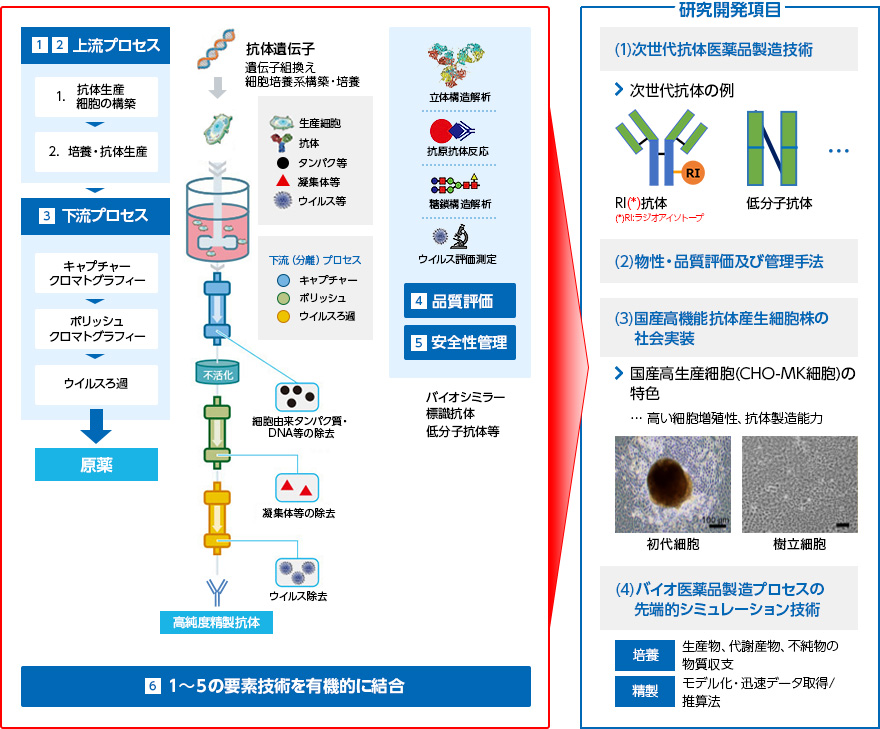
2018〜2020年度「バイオ医薬品の高度製造技術の開発」
高度な抗体医薬品生産技術の構築
研究項目
- 連続生産要素技術の開発
- ◦生産細胞
- ◦品質管理
- ◦細胞培養
- ◦ウイルス等安全性管理
- ◦ダウンストリーム
- 生産技術の実証(エンジラン)
- ◦GMP準拠
- 連続生産プロセスプラットフォームの構築
- ◦インテグレート型(一気通貫)
- ◦ハイブリッド型(バッチプロセスとの組合せ)
バイオ医薬品シーズ(創薬シーズタンパク質)の製造可能性アセスメント
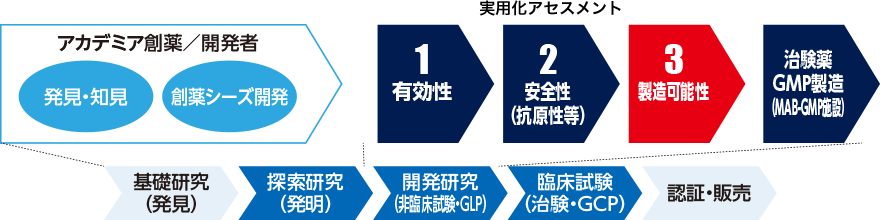
2013〜2017年度「国際基準に適合した次世代抗体医薬等の製造技術」
生産細胞構築技術の開発 (先進生産技術の開発)
- 国際基準に適合した宿主動物細胞迅速構築法の開発
- 宿主動物細胞の高度化・高品質化技術の開発
- 開発技術の融合による細胞構築プラットフォーム化
高性能細胞培養技術の開発
- 次世代シングルユース装置の開発
- 先進計測技術ならびにこれを活かした細胞培養制御技術の開発
高度ダウンストリーム技術の開発
- 分離剤の高度化技術の開発
- シングルユース精製部材の開発
- ウイルス除去及び不活化プロセスの開発
- 精製工程のパッケージ化
先進的品質評価技術開発
- バイオ医薬品の立体構造変化に伴う不均一性評価技術の開発
- バイオ医薬品の会合凝集に伴う不均一性評価技術の開発
- バイオ医薬品の翻訳後修飾に伴う不均一性評価技術の開発
- 開発技術の評価と融合
ウイルス安全性管理技術の開発
- ウイルス安全性評価試験実施体制の基盤整備
- ウイルス管理技術開発のための高感度検出技術
国際基準に適合した次世代プラットフォーム化技術の確立
- シングルユースシステムに基づいたプラットフォーム化技術の確立
- 小スケールから大スケールまでのプラットフォーム化技術の確立
- 国際標準化を目指した戦略の推進
- セルバンク構築体制の整備
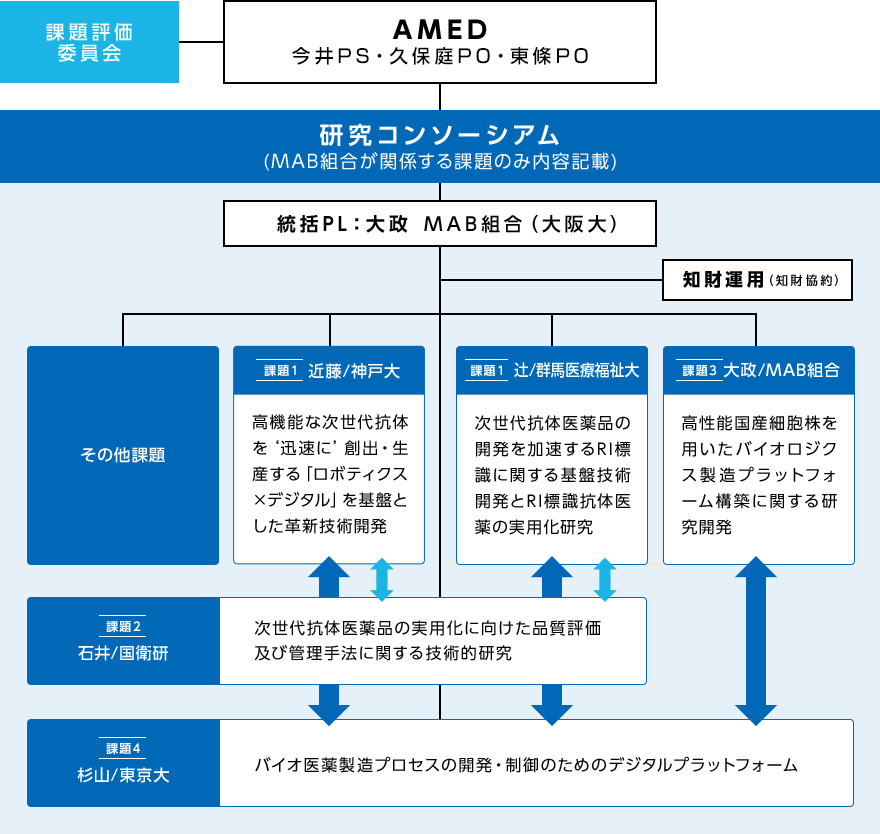
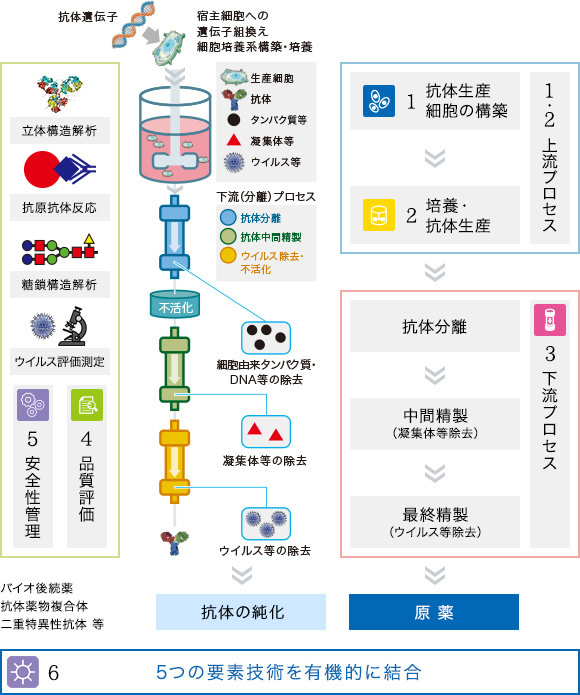 図 バイオ医薬品の製造工程と研究開発項目
図 バイオ医薬品の製造工程と研究開発項目